临床上,一些主动脉疾病的发生发展与血管壁的材料特性密切相关。因此,基于影像的病人特异性血管壁材料参数识别在生物力学研究中十分重要。
近期,复旦大学航空航天系心脑血管生物力学实验室王盛章课题组基于猪主动脉的动态CTA影像数据,提出了一种血管壁材料参数识别的方法;利用该方法对猪胸主动脉近端和远端的材料参数,并通过单轴拉伸实验对识别结果的准确性进行了验证。相关成果以标题“Material parameter identification of the proximal and distal segments of the porcine thoracic aorta based on ECG-gated CT angiography”发表在生物力学领域顶级期刊《Journal of Biomechanics》上。
本研究选用三阶Ogden本构模型,设置多组材料参数,使用主成分分析法(Principal Component Analysis, PCA)对不同的材料参数对应的应力矩阵进行降维处理。在PCA空间中将不同的材料参数映射为点集并进行初步分类处理后得到有限组材料参数以及应力-拉伸量的关系,然后构建不同层级之间的链接关系以逐级筛选出材料参数的最优解。上述过程如图1所示。

图1:材料参数的初步筛选过程。(a) 降维后PCA空间中的数据点。(b) 通过K-means聚类分析确定第1层的质量中心。(c) 在第1层级和第2层级中分别使用虚拟单轴拉伸试验得到的应力-应变曲线。(d) 构建PCA空间中两级数据点之间的链接网络。
接下来通过有限元模拟,将不同的材料参数赋予基于动态CT影像数据得到的舒张期模型,加载压力后使血管变形至收缩期,并计算模拟得到的收缩期模型与使用动态CTA影像数据得到的收缩期模型之间的距离。选择使距离最小化的一组材料参数作为最优解。不同层级的收缩期模型匹配情况和材料参数最优解对应的应力-拉伸量曲线如图2所示。
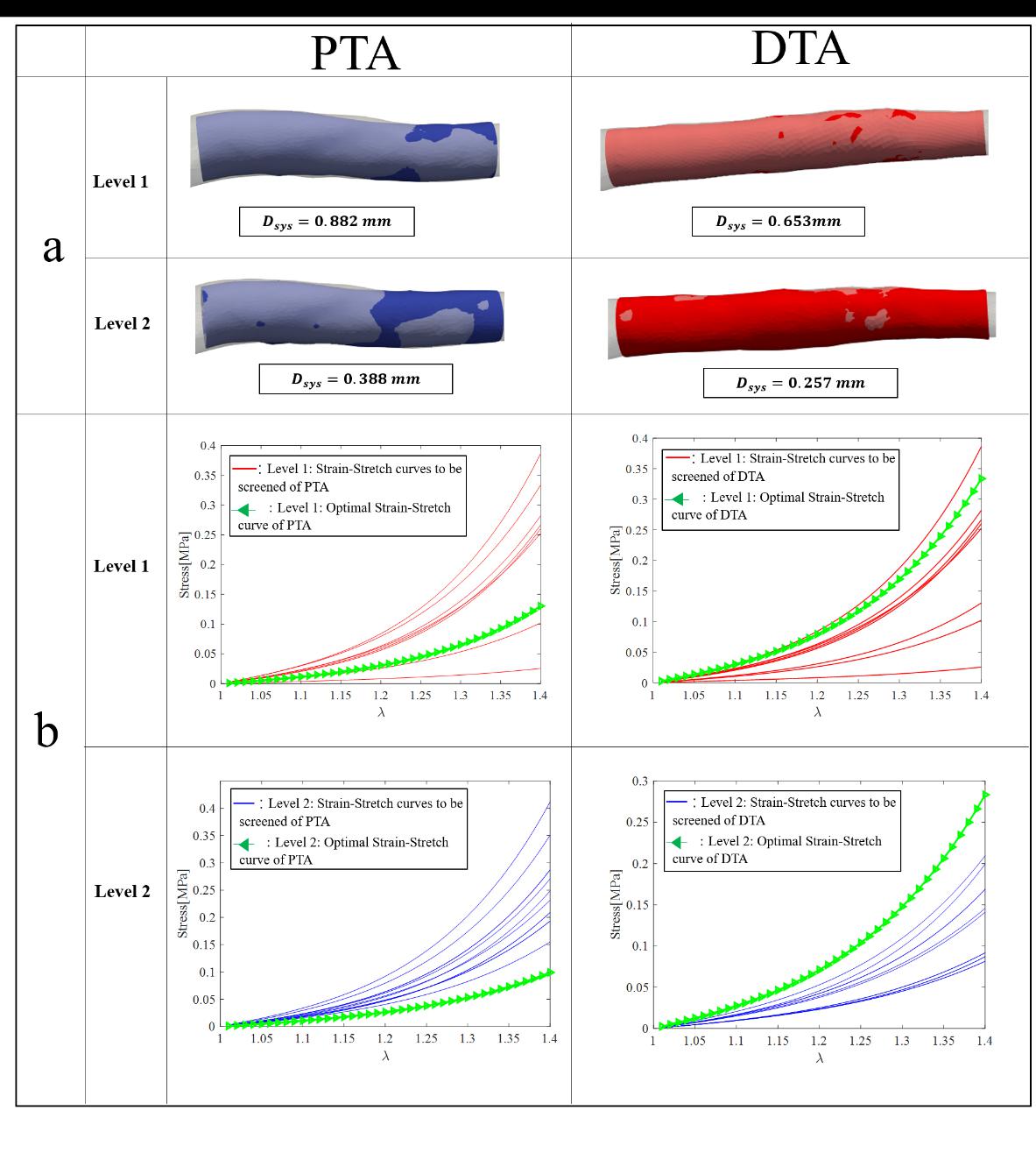
图2:胸主动脉近端:PTA;胸主动脉远端:DTA。(a) 使用第1层级和第2层级的材料参数最优解进行模拟后的收缩期模型与重建的收缩期模型匹配结果。蓝色:模拟的PTA收缩期模型。红色:模拟的DTA收缩期模型。半透明:基于动态CTA影像数据重建的收缩模型。(b) 红色实线:层级1级中的应力-应变曲线;蓝色实线:层级2的应力-应变曲线;绿色三角实线:材料参数最优解对应的应力-应变曲线。
最后,对一头实验猪进行解剖后取出对应的主动脉节段进行单轴拉伸实验,并将应力-应变曲线与材料参数最优解对应的单轴拉伸曲线进行对比,发现两段胸主动脉对应的单轴拉伸曲线的拟合优度分别为0.9953和0.9750。在0-0.3的应变范围内计算了两段胸主动脉的等效弹性模量,与实验得到的结果差异分别为1.08%和0.36%,如图3所示。上述结果表明在猪胸主动脉的生理变形范围内,本研究中材料参数逆向识别的方法具有准确性。
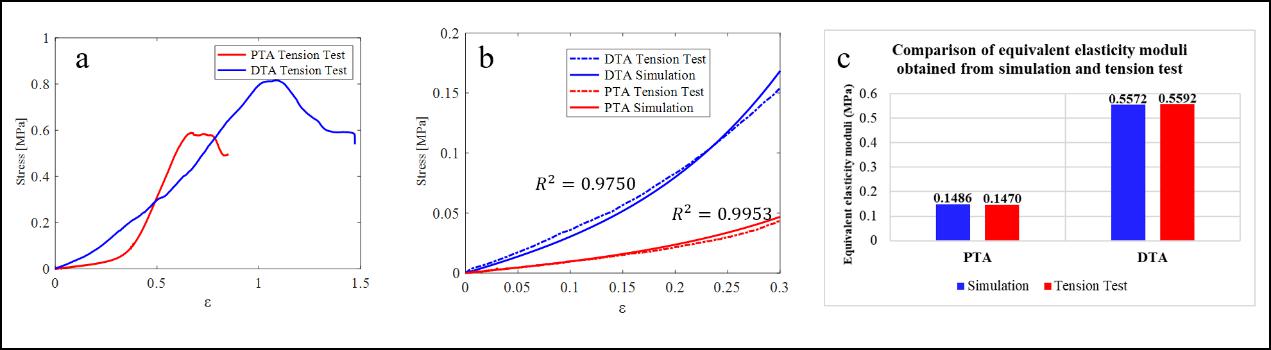
图3:(a) 单轴拉伸试验得到猪主动脉近端和远端的应力-应变曲线。(b) 当应变在0-0.3之间变化时,模拟和实验获得的猪胸主动脉近、远端的应力-应变曲线对比。(c) 模拟和体外单轴拉伸试验的等效弹性模量对比。
本研究中的方法可用于确定与主动脉疾病(如动脉瘤和主动脉夹层)相关的血管壁的材料参数,从而进行病人特异性的生物力学研究,为临床对主动脉疾病的精准诊疗提供帮助。
该文章的第一作者为复旦大学航空航天系直博生彭臣,共同第一作者为复旦大学附属中山医院血管外科硕士生邹凌威和影像科医生侯凯,论文通讯作者为航空航天系王盛章教授和中山医院董智慧主任医师,其他作者还有复旦大学附属中山医院血管外科的符伟国教授、法国里昂大学的BenyebkaBou-Said教授等人。本研究得到了国家自然科学基金委、上海市优秀学科带头人计划的支持。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0021929022001580#t0005


